วันเสาร์ที่ 20 กันยายน พ.ศ. 2557
วันศุกร์ที่ 19 กันยายน พ.ศ. 2557
วันศุกร์ที่ ไม่ สุข สมชื่อ
วันนี้ฉันไปเปิดบัญชีธนาคารมา และไปจ่ายค่าสมัครสอบ ม.ขอนแก่น
รู้สึกตื่นเต้น วันนี้ก็จ่ายไป 700 การสอบมหาลัยที่หลายๆคนหมายปอง
สู้ๆ บอกตัวเอง
I belive I can fly
รู้สึกตื่นเต้น วันนี้ก็จ่ายไป 700 การสอบมหาลัยที่หลายๆคนหมายปอง
สู้ๆ บอกตัวเอง
วันพฤหัสบดีที่ 18 กันยายน พ.ศ. 2557
วันพุธที่ 17 กันยายน พ.ศ. 2557
วันแรกของโควต้า มข.
วันนี้เป็นวันแรกนะของการสมัครโควต้า มข
รู้สึกตื่นเต้นอย่างบอกไม่ถูก
ฉันนั่งเฝ้ารอสมัครตั้งแต่ เช้า
แต่มาเปิดให้สมัครตอนบ่ายสอง
เป็นการสมัครสอบครั้งแรก ใจสั่นมากกกก
รู้สึกตื่นเต้นอย่างบอกไม่ถูก
ฉันนั่งเฝ้ารอสมัครตั้งแต่ เช้า
แต่มาเปิดให้สมัครตอนบ่ายสอง
เป็นการสมัครสอบครั้งแรก ใจสั่นมากกกก
ทำสังฆทานที่วัดสำราญ
วันอังคารที่ 16 ฉันได้ไปทำสังฆทานกับเพื่อนๆมา
พระท่านได้เทศนนาความเป็นมาของสังฆทานให้ฟัง
และให้ข้อคิดเตือนใจหลายๆอย่างในการดำเนินชีวิต
พระท่านได้เทศนนาความเป็นมาของสังฆทานให้ฟัง
และให้ข้อคิดเตือนใจหลายๆอย่างในการดำเนินชีวิต
วันอาทิตย์ที่ 14 กันยายน พ.ศ. 2557
ความคิด ความฝัน ความหวัง
วันนี้เป็นอีกวันที่ฉันเริ่มรู้สึกสับสับกับตัวเองว่าตัวเองต้องการที่จะเรียนต่อในสายอาชีพอะไรกันแน่
แต่มาถึงตอนนี้แล้ว ความฝัน ความหวังที่ฉันมีนั้นเริ่มจะชัดเจนขึ้นเรื่อยๆ
ฉันมีหมาลัยที่ฉันใฝ่ฝันคือ มหาวิทยาลัยเชียงใหม่ ฉันชอบมหาลัยนี้มากฉันมีความใฝ่ฝันอยากเรียนในหมาลัยนี้ตั้งแต่เด็กๆ ฉันจะสู้ต่อไปแล้วกัน
แต่มาถึงตอนนี้แล้ว ความฝัน ความหวังที่ฉันมีนั้นเริ่มจะชัดเจนขึ้นเรื่อยๆ
ฉันมีหมาลัยที่ฉันใฝ่ฝันคือ มหาวิทยาลัยเชียงใหม่ ฉันชอบมหาลัยนี้มากฉันมีความใฝ่ฝันอยากเรียนในหมาลัยนี้ตั้งแต่เด็กๆ ฉันจะสู้ต่อไปแล้วกัน
ถ่ายหนังสั้นงานแนะแนว
เบื้องหลังการถ่ายทำหนังสั้นเรื่องแรกในชีวิต บทบาทตัวละครที่ฉันได้รับคือ เป็นคนที่สับสนในการค้นหาตัวเอง ในขณะที่เราทำงานเราก็มีทั้งเสียงหัวเราะและความเครียด
วันเสาร์ที่ 13 กันยายน พ.ศ. 2557
ค่ายรับน้องห้อง 10 เมื่อวันที่ 6 กันยา
เป็นวันค่ายรับน้อง เตรียมงานเหนื่อย แต่พอเอาเข้าจริงๆเห็นน้องๆสนุกก็มีความสุขไปอีกแบบ
มีภาพบรรยากาศสนุกด้วย งานในวันนั้นทั้งพี่น้องห้อง 10 ได้มีการผูกแขนน้องด้วย มันเป็นอีกความรู้สึกที่ฉันไม่เคยได้รับรู้
มีภาพบรรยากาศสนุกด้วย งานในวันนั้นทั้งพี่น้องห้อง 10 ได้มีการผูกแขนน้องด้วย มันเป็นอีกความรู้สึกที่ฉันไม่เคยได้รับรู้
วันอาทิตย์ที่ 3 สิงหาคม พ.ศ. 2557
มหาวิทยาลัยที่เด็กไทยเข้าเข้า 10 อันดับ

10 มหาวิทยาลัยบูรพา
ม.บู แตกหน่อมาจาก มศว และพัฒนาไปไกลเกินกว่าจะเป็นแค่วิทยาเขต บูรพาปัจจุบันเปิดสอนในทุกสาขา ด้วยที่ตั้งไม่ไกลจากเมืองตากอากาศชายทะเลระดับโลกและการเดินทางที่ไม่ไกลจา กรุงเทพฯ ม.บูจึงเป็นที่นิยม 1 ใน 10 ของ มหาวิทยาลัยของไทย มหาวิทยาลัยบูรพา จึงได้รับการขนานนามในฐานะ “มหาวิทยาลัยแห่งภาคตะวันออก“

9 มหาวิทยาลัยสงขลานครินทร์
มอ ศูนย์กลางการศึกษาทางทิศทักษิณ มหาวิทยาลัย ที่เคยมีผลงานวิจัยในระดับเอเชีย จนถูกจัดให้อยู่ใน มหาวิทยาลัยอันดับที่ 1 ของไทยในหลายปีก่อน มอ ในปัจจุบันได้พัฒนาในฐานะ “มหาวิทยาลัยศูนย์กลางแห่งภาคใต้”

8 มหาวิทยาลัยขอนแก่น
มหาวิทยาลัยดินแดง แห่งแรกของภาคอิสาน กับการเป็นศูนย์กลางของการศึกษาของชาวตะวันออกเฉียงเหนือ มหาวิทยาลัยขอนแก่นในฐานะ “มหาวิทยาลัยศูนย์กลางของภาคตะวันออกเฉียงเหนือ”

7 มหาวิทยาลัยเชียงใหม่
มหาวิทยาลัยเชียงใหม่ มหาวิทยาลัย ในต่างจังหวัดแห่งแรกของไทย และเป็น มหาวิทยาลัยแห่งแรกของทางภาคเหนือ ด้วย ด้วยบรรยากาศของเมืองท่องเที่ยวระดับโลก มช จึงถูกพัฒนาเป็นศูนย์กลางทางการศึกษาขั้นสูงของทางภาคเหนือในฐานะ “มหาวิทยาลัยชั้นนำของภาคเหนือ”

6 มหาวิทยาลัยศรีนครินทรวิโรฒ
มหาวิทยาลัย ที่แตกหน่อวิทยาเขตมากมายจน กลายเป็นมหาวิทยาลัยอีกกว่า 3 แห่ง มศว ในปัจจุบันเป็น มหาวิทยาลัยที่เปิดสอนในทุกศาสตร์ ทั้งศิลปะ วิทยาศาสตร์ การแพทย์ แต่ในส่วนของคณะศึกษาศาสตร์นั้นยังคงเป็นเสาหลักที่สร้างชื่อเสียงให้กับ มศว ในฐานะ “มหาวิทยาลัยที่พัฒนาการศึกษาไทย”
 5 มหาวิทยาลัยศิลปากร
5 มหาวิทยาลัยศิลปากร
มหาวิทยาลัย ศูนย์กลางทางด้านศิลปะของไทย จัดตั้งเป็นลำดับที่ 5 พร้อมเกษตรและมหิดล ศิลปากรไม่ได้โดดเด่นแค่ศิลปะ ออกแบบ สถาปัตย์ โบราณคดี และดุริยางค์เท่านั้น ด้านภาษา วิทยาศาสตร์และเภสัชก็เป็นอีกสาขาที่มีผลงานโดดเด่น มหาวิทยาลัยศิลปากรในฐานะ “มหาวิทยาลัยศิลปะแห่งชาติ”
 4 มหาวิทยาลัยเกษตรศาสตร์
4 มหาวิทยาลัยเกษตรศาสตร์
มหาวิทยาลัย ที่เก่าแก่ ที่สุดเป็นลำดับที่ 4 ของไทยจัดตั้งพร้อมกับ มหิดลและศิลปากร เกษตรศาสตร์มิได้โดดเด่นในด้านเกษตรสมัยใหม่เท่านั้น แต่ในทางวิทยาศาสตร์และเทคโนโลยี มหาวิทยาลัยเกษตรศาสตร์ ก็ยังเป็นที่ยอมรับอีกด้วย เกษตรเคยครองตำแหน่ง มหาวิทยาลัย ยอดนิยมของไทยมาแล้วหลายสมัยในฐานะ “มหาวิทยาลัยวิทยาศาสตร์เกษตรและเทคโนโลยีของชาติ”
 3 มหาวิทยาลัยมหิดล
3 มหาวิทยาลัยมหิดล
อดีตวิทยาลัยแพทยศาสตร์ แห่งประเทศไทย ศูนย์กลางการศึกษาด้านการแพทย์และสาธารณสุขของประเทศปัจจุบันเป็น มหาวิทยาลัยไทยที่มีผลงานวิจัยในระดับนานาชาติและการจัดอันดับอยู่ที่ 30 ของเอเชียและอยู่ลำดับที่ 1 ของไทย มหาวิทยาลัยมหิดลในฐานะ “มหาวิทยาลัยวิทยาศาสตร์การแพทย์ของไทย”
 2 มหาวิทยาลัยธรรมศาสตร์
2 มหาวิทยาลัยธรรมศาสตร์
มหาวิทยาลัยธรรมศาสตร์ การเมืองและการปกครองของไทย มหาวิทยาลัยเก่าแก่อันดับที่ 2 ของไทยและมีชื่อเสียงในเรื่องกฏหมายและหลักปกครองปัจจุบันเปิดสอนในทุกสาขา มธ ในฐานะ “มหาวิทยาลัยการเมืองและประชาธิปไตยของไทย”
 1 จุฬาลงกรณ์มหาวิทยาลัย
1 จุฬาลงกรณ์มหาวิทยาลัย
มหาวิทยาลัยแห่งความฝันและเป็นที่หมายปอง ของนักเรียนมากที่สุดและเป็น มหาวิทยาลัยแห่งชาติ จุฬาฯเป็นมหาวิทยาลัยกลางเมืองหลวงของประเทศไทยมีบทบาทในฐานะ “มหาวิทยาลัยแห่งชาติและแห่งแรกของไทย”
สารเสพติดที่อันตราย
10 สารยาเสพติดอันตราย
1. สารยาเสพติดอันตราย?เฮโรอีน (Heroin)?
- เฮโรอีนเป็นยาเสพติดที่ได้จากการสังเคราะห์ทางเคมี จากปฏิกิริยาระหว่างมอร์ฟีนกับสารเคมีบางชนิด
- เช่น อาเซ-ติคแอนไฮไดรด์ (Aceticanhydride) หรือ อาเซติลคลอไรด์ (Acetylchloride) หรือเอทิลิดีนไดอาเซเตท?(Ethylidinediacetate)
- เฮโรอีนออกฤทธิ์แรงกว่ามอร์ฟีนประมาณ 4-8 เท่า และออกฤทธิ์แรงกว่าฝิ่น ประมาณ?30-90 เท่า
- โดยทั่วไปเฮโรอีนจะมีลักษณะเป็นผงสีขาว สีนวล หรือสีครีม มีรสขม ไม่มีกลิ่น
- เฮโรอีนที่แพร่ระบาดในประเทศไทย แบ่งเป็น 2 ชนิด คือ
1. เฮโรอีนผสม หรือเรียกว่าเฮโรอีนเบอร์ 3 หรือไอระเหย เป็นเฮโรอีนที่มีความบริสุทธิ์ต่ำ เนื่องจากมีการผสมสารอื่น
เข้าไปด้วย เช่น ผสมสารหนู สตริกนิน ยานอนหลับ กาเฟอีน แป้ง น้ำตาลและอาจผสมสี เช่น สีม่วงอ่อน สีชมพูอ่อน
สีน้ำตาล อาจพบในลักษณะเป็นผง เป็นเกล็ด หรืออัดเป็นก้อนเล็ก ๆ มีวิธีการเสพโดยการสูดเอาไอสารเข้าร่างกาย
จึงเรียกว่า “ไอระเหย” หรือ “แคป”
เข้าไปด้วย เช่น ผสมสารหนู สตริกนิน ยานอนหลับ กาเฟอีน แป้ง น้ำตาลและอาจผสมสี เช่น สีม่วงอ่อน สีชมพูอ่อน
สีน้ำตาล อาจพบในลักษณะเป็นผง เป็นเกล็ด หรืออัดเป็นก้อนเล็ก ๆ มีวิธีการเสพโดยการสูดเอาไอสารเข้าร่างกาย
จึงเรียกว่า “ไอระเหย” หรือ “แคป”
2. เฮโรอีนเบอร์ 4 เป็นเฮโรอีนไฮโดรคลอไรด์ที่มีความบริสุทธิ์สูง มีลักษณะเป็นผงละเอียด หรือเป็นเม็ดคล้ายไข่ปลา
หรือพบในลักษณะอัดเป็นก้อนสี่เหลี่ยมผืนผ้า มักมีสีขาวหรือสีครีม ไม่มีกลิ่น มีรสขม เป็นที่รู้จัดทั่วไปว่า “ผงขาว”
มักเสพโดยนำมาละลายน้ำและฉีดเข้าร่างกาย หรือผสมบุหรี่สูบ
หรือพบในลักษณะอัดเป็นก้อนสี่เหลี่ยมผืนผ้า มักมีสีขาวหรือสีครีม ไม่มีกลิ่น มีรสขม เป็นที่รู้จัดทั่วไปว่า “ผงขาว”
มักเสพโดยนำมาละลายน้ำและฉีดเข้าร่างกาย หรือผสมบุหรี่สูบ
ฤทธิ์ในทางเสพติด
- เฮโรอีนออกฤทธิ์กดระบบประสาท มีอาการเสพติดทั้งทางร่างกายและจิตใจ มีอาการขาดยาทางร่างกายอย่างรุนแรง
- มีอาการปวดกล้ามเนื้อ ปวดกระดูก ปวดตามข้อ ปวดสันหลัง ปวดบั้นเอว ปวดหัวรุนแรง มีอาการจุกแน่นในอกคล้ายใจจะขาด อ่อนเพลียอย่างหนัก หมดเรี่ยวแรงมีอาการหนาว ๆ ร้อน ๆ อึดอัดทุรุนทุราย นอนไม่หลับ กระสับกระส่าย
- บางรายมีอาการชักตาตั้ง น้ำลายฟูมปาก ม่านตาดำหดเล็กลง ใจคอหงุดหงิดฟุ้งซ่าน มึนงง หายใจไม่ออก ประสาทเสื่อม?ความจำเสื่อม
- ผู้เสพติดเฮโรอีนที่ติดเชื้อ HIV ก็จะเป็นผู้แพร่ระบาด HIV เนื่องจากการจับกลุ่มใช้เข็มฉีดยาร่วมกันหรือ?ในบางครั้งก็มีเพศสัมพันธ์ร่วมกัน โดยไม่ได้ป้องกัน
โทษทางกฎหมาย
- จัดเป็นยาเสพติดให้โทษประเภท 1 ตามพระราชบัญญัติยาเสพติดให้โทษ พ.ศ. 2522
2.?สารยาเสพติดอันตราย ยาบ้า (Amphetamine)?
- ยาบ้า เป็นชื่อที่ใช้เรียกยาเสพติดที่มีส่วนผสมของสารเคมี ประเภทแอมเฟตามีน (Amphetamine)
- ยาบ้า จัดอยู่ในกลุ่มยาเสพติดที่ออกฤทธิ์กระตุ้นประสาท มีลักษณะเป็นยาเม็ดกลมแบนขนาดเล็ก?มีสีต่างๆ กัน เช่น สีส้ม สีน้ำตาล
- มีสัญลักษณ์ที่ปรากฏบนเม็ดยา เช่น ฬ, M, PG, WY สัญลักษณ์รูปดาว เป็นต้น
ฤทธิ์ในทางเสพติด :
- ออกฤทธิ์กระตุ้นประสาท มีอาการเสพติดทั้งทางร่างกายและจิตใจ ไม่มีอาการขาดยาทางร่างกาย
- เมื่อเสพเข้าสู่ร่างกายในระยะแรกจะออกฤทธิ์ทำให้ร่างกายตื่นตัว หัวใจเต้นเร็ว ความดันโลหิตสูง ใจสั่น ประสาทตึงเครียด แต่เมื่อหมดฤทธิ์ยา จะรู้สึกอ่อนเพลียมากกว่าปกติ ประสาทล้าทำให้การตัดสินใจช้า และผิดพลาด เป็นเหตุให้เกิดอุบัติเหตุร้ายแรงได้
- ถ้าใช้ติดต่อกันเป็นเวลานาน จะทำให้สมองเสื่อม เกิดอาการประสาทหลอน เห็นภาพลวงตา หวาดระแวง คลุ้มคลั่ง เสียสติ?เป็นบ้าอาจทำร้ายตนเองและผู้อื่นได้ หรือในกรณีที่ได้รับยาในปริมาณมาก (Overdose) จะไปกดประสาท และระบบการหายใจทำให้หมดสติ และถึงแก่ความตายได้
โทษทางกฎหมาย
- จัดเป็นยาเสพติดให้โทษประเภท 1 ตามพระราชบัญญัติยาเสพติดให้โทษ พ.ศ. 2522
3. สารยาเสพติดอันตราย?ยาอี ยาเลิฟ เอ็คซ์ตาซี (Ecstasy)
- ยาอี ยาเลิฟ เอ็คซ์ตาซี (Ecstasy) เป็นยาเสพติดกลุ่มเดียวกัน จะแตกต่างกันบ้างในด้านโครงสร้างทางเคมี
- ลักษณะ?ของยาอี มีทั้งที่เป็นแคปซูลและเป็นเม็ดยาสีต่าง ๆ แต่ที่พบในประเทศไทย ส่วนใหญ่มีลักษณะเป็นเม็ดกลมแบน?ผิวเรียบ และปรากฏสัญลักษณ์บนเม็ดยาเป็นรูปต่าง ๆ เช่น กระต่าย ฯลฯ
ฤทธิ์ในทางเสพติด?
- จะออกฤทธิ์ภายในเวลา 45 นาที และฤทธิ์ยา?จะอยู่ในร่างกายได้นานประมาณ 6-8 ซม. แพร่ระบาดในกลุ่มวัยรุ่นที่ชอบเที่ยวกลางคืน
- ออกฤทธิ์กระตุ้นประสาทในระยะสั้น ๆ จากนั้นจะออกฤทธิ์หลอนประสาท มีอาการติดยาทางจิตใจ ไม่มีอาการขาดยา?ทางร่างกาย เหงื่อออกมาก หัวใจเต้นเร็ว ความดันโลหิตสูง ระบบประสาทการรับรู้เกิดการเปลี่ยนแปลงทั้งหมด?(Psychedelic) ทำให้การได้ยินเสียงและการมองเห็นแสงสีต่าง ๆ ผิดไปจากความเป็นจริง เคลิบเคลิ้ม ควบคุมอารมณ์ไม่ได้
โทษทางกฎหมาย
- จัดเป็นยาเสพติดให้โทษประเภท 1 ตามพระราชบัญญัติยาเสพติดให้โทษ พ.ศ. 2522
4. สารยาเสพติดอันตราย?โคเคน (Cocaine) :
- โคเคน หรือ โคคาอีนเป็นยาเสพติด ที่สกัดได้จากใบของต้นโคคา??ซึ่งเป็นต้นไม้ที่ลักลอบปลูกมากในประเทศแถบอเมริกาใต้ เช่น เปรู โบลิเวีย และโคลัมเบีย เป็นต้น
- โคเคนมีชื่อเรียกในกลุ่ม?ผู้เสพว่า COKE, Snow, Speed Ball, Crack
- โคเคนที่พบในประเทศไทย มี 2 ชนิด ได้แก่?1. โคเคนชนิดผง มีลักษณะเป็นผงละเอียดสีขาว รสขม ไม่มีกลิ่น?2. โคเคนรูปผลึกเป็นก้อน (Free base, Crack)
ฤทธิ์ในทางเสพติด
- โคเคนออกฤทธิ์กระตุ้นประสาท มีอาการเสพติดทางร่างกายเล็กน้อย ขึ้นอยู่กับวิธีการและปริมาณที่เสพ มีอาการทาง?จิตใจ อาจมีอาการขาดยาทางร่างกายแต่ไม่รุนแรง หัวใจเต้นแรง ความดันโลหิตสูง กระวนกระวาย ตัวร้อนมีไข้?นอนไม่หลับ มีอาการซึมเศร้า ผนังจมูกขาดเลือด ทำให้เยื่อบุโพรงจมูกฝ่อ ขาดหรือทะลุ สมองถูกกระตุ้นอย่างรุนแรง?ทำให้เกิดอาการชักมีเลือดออกในสมอง เนื้อสมองตายเป็นบางส่วน หัวใจถูกกระตุ้นอยู่เสมอ กล้ามเนื้อหัวใจเสื่อมลง?ทีละน้อยจนหัวใจบีบตัวไม่ไหวทำให้หัวใจล้มเหลว ผลจากการเสพเป็นระยะเวลานาน ทำให้เกิดอาการโรคจิตซึมเศร้า
โทษทางกฎหมาย
- จัดเป็นยาเสพติดให้โทษประเภท 2 ตามพระราชบัญญัติยาเสพติดให้โทษ พ.ศ. 2522
 5. สารยาเสพติดอันตราย?ฝิ่น (Opium)
5. สารยาเสพติดอันตราย?ฝิ่น (Opium)- ฝิ่นเป็นสารประกอบชนิดหนึ่ง ซึ่งได้จากยางของผลฝิ่น ในเนื้อฝิ่นมีสารเคมีผสมอยู่มากมาย ซึ่งประกอบด้วย โปรตีน?เกลือแร่ ยางและกรดอินทรีย์เป็นแอลคะลอยด์ (Alkaloid) ซึ่งเป็นตัวการสำคัญ ที่ทำให้ฝิ่นกลายเป็นสารเสพติดให้โทษ?ที่ร้ายแรง และเป็นยาเสพติดที่เป็นต้นตอของยาเสพติดร้ายแรง เช่น มอร์ฟีน เฮโรอีน และโคเคอีน มีการลักลอบปลูกฝิ่น?มากทางภาคเหนือของประเทศไทยบริเวณแนวพรมแดน ที่เรียกว่า “สามเหลี่ยมทองคำ”
ฤทธิ์ในทางเสพ?
- ฝิ่นออกฤทธิ์กดระบบประสาท มีอาการเสพติดทั้งทางร่างกายและจิตใจ มีอาการขาดยาทางร่างกาย หากเสพเกินขนาด?จะทำให้กดระบบหายใจทำให้เสียชีวิต จิตใจเลื่อนลอย ง่วง ซึม แก้วตาหรี่ พูดจาวกวน ความคิดเชื่องช้า ไม่รู้สึกหิวชีพจรเต้นช้า
โทษทางกฎหมาย
- จัดเป็นยาเสพติดให้โทษประเภท 2 ตามพระราชบัญญัติยาเสพติดให้โทษ พ.ศ. 2522
6. สารยาเสพติดอันตราย?มอร์ฟีน (Morphine)
- มอร์ฟีนเป็นแอลคะลอยด์ (Alkaloid) ของฝิ่นที่สำคัญที่สุด ซึ่งเป็นตัวการที่ออกฤทธิ์กดประสาท
- มอร์ฟีนเป็นผงสีขาว?หรือเทาเกือบขาว ไม่มีกลิ่น มีรสขม มีฤทธิ์สูงกว่าฝิ่น เสพติดได้ง่าย มีลักษณะเป็นเม็ด เป็นผง และเป็นก้อน หรือละลาย
บรรจุหลอดสำหรับฉีด นำเข้าสู่ร่างกายโดยวิธีฉีดเป็นส่วนมาก - ?มอร์ฟีนใช้เป็นยาหลักหรือยามาตรฐานของยาแก้ปวด?ยาจำพวกนี้กดระบบประสาทส่วนกลาง ลดความรู้สึกเจ็บปวด ทำให้รู้สึกง่วงหลับไป และลดการทำงานของร่างกาย
- อาการข้างเคียงอื่น ๆ ก็คือ อาจทำให้คลื่นเหียนอาเจียน ท้องผูก เกิดอาการคันหน้า ตาแดงเพราะโลหิตฉีด ม่านตาดำ
หดตีบ และหายใจลำบาก
ฤทธิ์ทางเสพติด
- มอร์ฟีนออกฤทธิ์กดระบบประสาท มีอาการเสพติดทั้งร่างกายและจิตใจ มีอาการขาดยาทางร่างกาย คลื่นเหียนอาเจียน?ท้องผูก เกิดอาการคันหน้า ตาแดง ซึม ง่วงนอน ไม่สนใจสิ่งแวดล้อม ร่างการทรุดโทรม สมองมึนชา สติปัญญาเสื่อมโทรม
โทษทางกฎหมาย
- จัดเป็นยาเสพติดให้โทษประเภท 2 ตามพระราชบัญญัติยาเสพติดให้โทษ พ.ศ. 2522
7. สารยาเสพติดอันตราย?กัญชา (Cannabis) :
- กัญชา มีลักษณะใบจะแยกออกเป็นแฉกประมาณ 5-8 แฉกคล้ายใบมันสำปะหลังที่ขอบใบทุกใบจะมีรอยหยัก?ออกดอกเป็นช่อเล็กๆ ตามง่ามของกิ่งและก้าน ส่วนที่คนนำมาเสพได้แก่ส่วนของกิ่ง ก้าน ใบ?และยอดช่อดอกกัญชา
- โดยนำมาตากหรืออบแห้ง แล้วบดหรือหั่นให้เป็นผงหยาบๆ จากนั้นจึงนำมายัดไส้บุหรี่สูบ ยังอาจพบในรูปของ ?น้ำมันกัญชา? (Hashish Oil) ซึ่งมีลักษณะเป็นของเหลวสีน้ำตาลเข้มหรือสีดำ
ฤทธิ์ทางเสพติด
- กัญชาเป็นยาเสพติดให้โทษ ที่ออกฤทธิ์หลายอย่างต่อระบบประสาทส่วนกลาง คือ ทั้งกระตุ้นประสาทกดและหลอนประสาท สารออกฤทธิ์ที่อยู่ในกัญชามีหลายชนิด แต่สารที่สำคัญที่สุดที่มีฤทธิ์ต่อสมองและทำให้ร่างกาย อารมณ์ และจิตใจเปลี่ยนแปลงไป
- ในเบื้องต้นจะออกฤทธิ์กระตุ้นประสาท ทำให้ผู้เสพตื่นเต้น ช่างพูด และหัวเราะตลอดเวลา ต่อมาจะกดประสาท ทำให้ผู้เสพมีอาการคล้ายเมาเหล้าอย่างอ่อนๆ?เซื่องซึม และง่วงนอน หากเสพเข้าไปในปริมาณมากๆ จะหลอนประสาททำให้เห็นภาพลวงตา หูแว่ว ความคิด?สับสน ควบคุมตนเองไม่ได้??ทำลาย
ระบบภูมิคุ้มกันของร่างกาย ทำลายสมอง ปอด
โทษทางกฎหมาย
- จัดเป็นยาเสพติดให้โทษประเภท 5 ตามพระราชบัญญัติยาเสพติดให้โทษ พ.ศ. 2522
8. สารยาเสพติดอันตราย?กระท่อม (Kratom)
- กระท่อม เป็นพืชเสพติดชนิดหนึ่ง ส่วนมากพบในทวีปเอเชีย โดยเฉพาะในประเทศอินเดียและในเอเชียตะวันออกเฉียงใต้ ประเทศมาเลเซีย อินโดนีเซีย ประเทศไทย ลักษณะเป็นต้นไม้ยืนต้นขนาดกลางมีแก่นเป็นเนื้อไม้แข็ง
- ใช้ส่วนของใบเป็นสิ่งเสพติด ลักษณะใบคล้ายกระดังงาหรือใบฝรั่งต้นหนาทึบ ต้นกระท่อมมี 2 ชนิด คือ?ก้านเขียวและก้านแดง
ฤทธิ์ในทางเสพ?
- ในใบกระท่อมมีสารไมตราจัยนินที่ออกฤทธิ์กระตุ้นประสาท มีอาการเสพติดทางร่างกายเล็กน้อย มีอาการเสพติด?ทางจิตใจ อาจมีอาการขาดยาทางร่างกายแต่ไม่รุนแรง ทำงานไม่รู้จักเหน็ดเหนื่อย ทนแดดไม่รู้สึกร้อน ทำให้?ผิวหนังไหม้เกรียมมีอาการมีนงง ปากแห้ง นอนไม่หลับ ท้องผูก แต่จะรู้สึกหนาวสั่น เมื่อมีอากาศชื้น หรือเมื่อฝนฟ้า?คะนอง ร่างการทรุดโทรม มีอาการประสาทหลอน จิตใจสับสน
โทษทางกฎหมาย
- กระท่อมเป็นยาเสพติดให้โทษประเภท 5 ตามพระราชบัญญัติยาเสพติดให้โทษ พ.ศ. 2522
9. สารยาเสพติดอันตราย?เห็ดขี้ควาย (Magic Mushroom) :
- เห็ดขี้ควายเป็นเห็ดพิษซึ่งขึ้นอยู่ตามกองมูลควายแห้ง สีของเห็ดจะมีสีเหลืองซีด คล้ายสีฟางแห้ง บนหัวของร่ม?จะมีสีน้ำตาลเข้มจนถึงสีดำบริเวณก้าน (Stalk) บริเวณใกล้ตัวร่มจะมีแผ่นเนื้อเยื่อบางๆ สีขาว แผ่ขยายออก?รอบก้าน แผ่นนี้มีลักษณะคล้ายวงแหวน
ฤทธิ์ในทางเสพติด?
- ในเห็ดขี้ควายมีสารออกฤทธิ์ทำลายประสาทอย่างรุนแรงคือ ไซโลซีน และ ไซโลไซบีน ผสมอยู่ ซึ่งออกฤทธิ์?หลอนประสาท เมื่อบริโภคเข้าไปจะทำให้มีอาการเมา เคลิบเคลิ้มและบ้าคลั่งในที่สุด หากบริโภคเข้าไปมากๆ?หรือผู้ที่บริโภคเข้าไปมีภูมิต้านทานน้อย อาจทำให้เกิดอันตรายถึงแก่ชีวิตได้
โทษทางกฎหมาย?
- เห็ดขี้ควายจัดเป็นยาเสพติดให้โทษประเภทที่ 5 ตามพระราชบัญญัติยาเสพติดให้โทษ พ.ศ.2522
10. สารยาเสพติดอันตราย?ยาเค (ketamine)
- ยาเค มาจากคำว่า เคตามีน (ketamine) หรือชื่อทางการค้าว่า เคตาวา (Ketava) หรือเคตาลา (Ketalar)?หรือคาสิบโชล
- ซึ่งตามพระราชบัญญัติวัตถุออกฤทธิ์ต่อจิตและประสาท พ.ศ. 2518 เป็นวัตถุออกฤทธิ์ใน?ประเภท 2 หมายถึง ยาที่มีอันตรายสูงที่แพทย์จะจ่ายให้กับผู้ป่วย เฉพาะเมื่อมีความจำเป็นจริง ๆ เท่านั้น
- สาเหตุที่ทำให้ยาเคกลายเป็นปัญหา เพราะวัยรุ่นบางกลุ่มได้นำยาเคมาใช้เป็นสิ่งมึนเมา โดยนำมาทำให้เป็นผง?นำมาสูดดมเพื่อให้เกิดอาการมึนเมา และมักพบว่ามีการนำยาเค มาใช้ร่วมกับยาเสพติดร้ายแรงชนิดอื่น เช่น ยาอี และโคเคน
ฤทธิ์ในทางเสพติด
- ยาเค เป็นยาที่ออกฤทธิ์หลอนประสานอย่างรุนแรง เมื่อเสพ?เข้าไปจะรู้สึกเคลิบเคลิ้ม (Euphoria) รู้สึกว่าตนเองมีอำนาจพิเศษ (Mystical) มีอาการสูญเสียกระบวนการ?ทางความคิด ความคิดสับสน การรับรู้และตอบสนองต่อสิ่งแวดล้อมทั้งภาพ แสง สี เสียงจะเปลี่ยนแปลงไป
- ตาลาย ร่างกายเคลื่อนไหวไม่สัมพันธ์กัน หากใช้ปริมาณมากจะเกิดการติดขัดในการหายใจ ?หากใช้ติดต่อกันเป็นเวลานาน จะปรากฏอาการเช่นนี้อยู่บ่อย ๆ เรียกว่า Flashback ซึ่งท้ายที่สุดแล้ว?จะทำให้ผู้เสพประสพกับสภาวะโรคจิต และกลายเป็นคนวิกลจริตได้
- ความคิดสับสน ตาลาย หูแว่ว การรับรู้และ?การตอบสนองต่อสิ่งแวดล้อมจะเปลี่ยนแปลงไป การเคลื่อนไหวของร่างกายไม่สัมพันธ์กัน
กฎหมายยาเสพติด ที่วัยรุ่นควรรู้!!
ข้อมูลเพิ่มเติม ?http://elib.fda.moph.go.th/library/default.asp?page2=subdetail&id_L1=27&id_L2=15682&id_L3=1228
เรียบเรียง teen.mthai อ้างอิง?nct.ago.go.th,คณะเภสัชศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย
วันศุกร์ที่ 11 กรกฎาคม พ.ศ. 2557
ปฏิกิริยาเคมีไฟฟ้า หรือปฏิกิริยารีดอกซ์
ปฏิกิริยารีดอกซ์ คือ ปฏิกิริยาเคมี ที่มีการแลกเปลี่ยนอิเล็กตรอนระหว่างสารตั้งต้นทำให้เลขออกซิเดชันมีการเปลี่ยนแปลงไป ซึ่งจะทำให้มีอะตอมของธาตุบางตัวสูญเสียหรือได้รับอิเล็กตรอน จะเรียกปฏิกิริยาที่เกิดการเสียอิเล็กตรอนว่า ปฏิกิริยาออกซิเดชัน (Oxidation) และเรียกปฏิกิริยาที่มีการรับอิเล็กตรอนว่า ปฏิกิริยารีดักชัน (Reduction) ดังตัวอย่าง
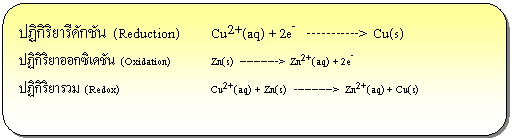
ปฏิกิริยาเคมีไฟฟ้า หรือปฏิกิริยารีดอกซ์สามารถนำไปใช้ประโยชน์ในชีวิตประจำวันมากมาย เช่น การชุบโลหะ การทำแบตเตอร์รี่ การแยกสารด้วยไฟฟ้า การทำสารให้บริสุทธิ์ เป็นต้น
เลขออกซิเดชัน ( Oxidation number หรือ Oxidation state )
เลขออกซิเดชัน ย่อว่า ON. คือค่าประจุไฟฟ้าที่สมมติขึ้นของไอออนหรืออะตอมของธาตุ โดยคิดจากจำนวนอิเล็กตรอนที่ให้หรือรับหรือใช้ร่วมกับอะตอมของธาตุตามเกณฑ์ที่กำหนดขึ้น เลขออกซิเดชันส่วนใหญ่เป็นเลขจำนวนเต็มบวกหรือลบหรือศูนย์
ในสารประกอบไอออนิกอะตอมมีการให้และรับอิเล็กตรอนแล้วกลายเป็นไอออนบวกและไอออนลบ ดังนั้นเลขออกซิเดชันจึงตรงกับค่าประจุไฟฟ้าที่แท้จริง ซึ่งมีค่าเท่ากับประจุไฟฟ้าของไอออนนั้นๆ ในสารประกอบโคเวเลนต์ อะตอมของธาตุใช้อิเล็กตรอนร่วมกันไม่ได้มีการให้และรับอิเล็กตรอนเหมือนกับในสารประกอบไอออนิก ดังนั้นในกรณีนี้เลขออกซิเดชันเป็นแต่เพียงประจุสมมติ ส่วนอะตอมของธาตุใดจะมีค่าเลขออกซิเดชันเป็นบวกหรือลบ ให้พิจารณา ค่าอิเล็กโทรเนกาติวิตี อะตอมของธาตุที่มีค่าอิเล็กโทรเนกาติวิตีสูงกว่าจะมีเลขออกซิเดชันเป็นลบ ส่วนอะตอมของธาตุที่มีค่าอิเล็กโทรเนกาติวิตีต่ำกว่าจะมีเลขออกซิเดชันเป็นบวก ส่วนจะมีค่าบวกเท่าไรนั้นพิจารณาได้จากจำนวนเวเลนซ์อิเล็กตรอนที่อะตอมของธาตุนำไปใช้ร่วมกับอะตอมของธาตุอื่น
หลักเกณฑ์ในการกำหนดค่าเลขออกซิเดชัน
การกำหนดเลขออกซิเดชันมีเกณฑ์ดังนี้
1. เลขออกซิเดชันของธาตุอิสระทุกชนิดไม่ว่าธาตุนั้นหนึ่งโมเลกุลจะประกอบด้วย กี่อะตอมก็ตามมีค่าเท่ากับศูนย์ เช่น Na, Zn, Cu, He, H 2, N 2, O 2, Cl 2, P 4, S 8 ฯลฯ มีเลขออกซิเดชันเท่ากับศูนย์2. เลขออกซิเดชันของไฮโดรเจนในสารประกอบโดยทั่วไป (H รวมตัวกับอโลหะ ) เช่น HCl , H 2O , H 2SO 4 ฯลฯ มีค่าเท่ากับ + 1 แต่ในสารประกอบไฮไดรด์ของโลหะ (H รวมตัวกับโลหะ ) เช่น NaH , CaH 2 ไฮโดรเจนมีเลขออกซิเดชันเท่ากับ -13. เลขออกซิเดชันของออกซิเจนในสารประกอบโดยทั่วไปเท่ากับ -2 แต่ในสารประกอบเปอร์ออกไซด์ เช่น H 2O 2 และ BaO 2 ออกซิเจนมีเลขออกซิเดชันเท่ากับ -1 ในสารประกอบซุปเปอร์ออกไซด์ ออกซิเจนมีเลขออกซิเดชันเท่ากับ -1/2 และในสารประกอบ OF 2 เท่านั้น ที่ออกซิเจนมีเลขออกซิเดชันเท่ากับ +24. เลขออกซิเดชันของไอออนที่ประกอบด้วยอะตอมชนิดเดียวกันมีค่าเท่ากับประจุที่แท้จริงของไอออนนั้น เช่น Mg 2+ ไอออน มีเลขออกซิเดชันเท่ากับ +2 ,F - ไอออนมีเลขออกซิเดชันเท่ากับ -1 เป็นต้น5. ไอออนที่ประกอบด้วยอะตอมมากกว่าหนึ่งชนิด ผลรวมของเลขออกซิเดชันของอะตอมทั้งหมดจะเท่ากับประจุที่แท้จริงของไอออนนั้น เช่น SO 4 2- ไอออน เท่ากับ – 2 เลขออกซิเดชันของ NH 4 + ไอออนเท่ากับ + 1 เป็นต้น6. ในสารประกอบใดๆ ผลบวกของเลขออกซิเดชันของอะตอมทั้งหมดเท่ากับศูนย์ เช่น H 2O H มีเลขออกซิเดชันเท่ากับ + 1 แต่มี H 2 อะตอม จึงมีเลขออกซิเดชันทั้งหมด เท่ากับ + 2 O มีเลขออกซิเดชันเท่ากับ – 2 เมื่อรวมกันจะเท่ากับศูนย์เป็นต้น
เพิ่มเติม
1. ธาตุหมู่ IA , IIA , IIIA ในสารประกอบต่างๆ มีเลขออกซิเดชันเท่ากับ +1 , + 2 , + 3 ตามลำดับ2. ธาตุอโลหะส่วนใหญ่ในสารประกอบมีเลขออกซิเดชันได้หลายค่า เช่น Cl ใน HCl HClO HClO 2 HClO 3 และ HClO 4 มีเลขออกซิเดชันเท่ากับ - 1, +1, +3, +5 และ +7 ตามลำดับ3. ธาตุแทรนซิชันส่วนใหญ่มีเลขออกซิเดชันได้มากกว่าหนึ่งค่า เช่น Fe ใน FeO และ Fe 2O 3 มีเลขออกซิเดชันเท่ากับ +2 และ +3 ตามลำดับ
การหาเลขออกซิเดชัน การหาเลขออกซิเดชันอาจทำได้โดยวิธีดังนี้
1. สมมติเลขออกซิเดชันของธาตุที่ต้องการหา2. นำค่าเลขออกซิเดชันของธาตุที่ทราบแล้ว และเลขออกซิเดชันของธาตุที่ต้องการหาเขียนเป็นสมการตามข้อตกลงในข้อ 5 และข้อ 6 แล้วแก้สมการเพื่อหาเลขออกซิเดชันของธาตุ ดังกล่าว3. สำหรับสารประกอบไอออนิก ที่ประกอบด้วยไอออนเชิงซ้อน และไม่ทราบค่า เลขออกซิเดชันของธาตุมากกว่า 1 ธาตุ เมื่อต้องการหาค่าเลขออกซิเดชันของธาตุ ควรแยกเป็นไอออนบวกและไอออนลบก่อน จึงสมมติค่าเลขออกซิเดชันของธาตุที่ต้องการหา แล้วนำ ค่าเลขออกซิเดชันของธาตุที่ทราบแล้วกับธาตุที่ต้องการทราบไปเขียนสมการตามข้อตกลงในข้อ 5 จากนั้นจึงแก้สมการเพื่อหาเลขออกซิเดชันของธาตุดังกล่าว
ตัวอย่างที่ 1 จงหาเลขออกซิเดชันของ Cr ใน [ Cr(H 2O) 4Cl 2]ClO 4
วิธีทำ H 2O มีเลขออกซิเดชันเท่ากับ 0Cl - มีเลขออกซิเดชันเท่ากับ - 1ClO 4 มีเลขออกซิเดชันเท่ากับ - 1ให้ Cr มีเลขออกซิเดชันเท่ากับ AA + ( 0 x 4 ) + ( - 1 x 2 ) + ( - 1 ) = 0A = + 1 + 2 = + 3ดังนั้น Cr มีเลขออกซิเดชันเท่ากับ + 3
ขั้นตอนการดุลสมการรีดอกซ์
1. หาธาตุที่มี O.N. เปลี่ยนไป ต่อ 1 อะตอมของธาตุ
2. นำเลข O.N. ที่เปลี่ยนไปมาคูณไขว้ (เพื่อให้จำนวน e- ที่ถ่ายเทเท่ากัน)
2. นำเลข O.N. ที่เปลี่ยนไปมาคูณไขว้ (เพื่อให้จำนวน e- ที่ถ่ายเทเท่ากัน)
EX. FeCl3 + SnCl2  FeCl2 + SnCl4
FeCl2 + SnCl4
1. หาเลข O.N. ที่เปลี่ยนไป ต่อ 1 อะตอมของธาตุ
FeCl3 + SnCl2  FeCl2 + SnCl4
FeCl2 + SnCl4
+3 +2 +2 +4
Fe รับ 1 e- Sn เสีย 2 e-
2. คูณไขว้จำนวน e- ให้ถ่ายเทเท่ากัน
2FeCl3 + SnCl2  FeCl2 + SnCl4
FeCl2 + SnCl4
3. ดุลสมการ
2FeCl3 + SnCl2  2FeCl2 + SnCl4 #
2FeCl2 + SnCl4 #
เซลล์กัลวานิก
ได้กล่าวถึงปฏิกิริยารีดอกซ์ที่เกิดขึ้นเมื่อนำแผ่นสังกะสีจุ่มลงในสารละลายของทองแดง หรือตัวรีดิวซ์จุ่มลงในตัวออกซิไดซ์โดยตรงแล้วในบทนำ ปฏิกิริยาที่เกิดขึ้นทำให้เกิดพลังงานในรูปของความร้อน แต่ถ้าแยกตัวรีดิวซ์ออกจากตัวออกซิไดซ์ แล้วเชื่อมต่อวงจรภายนอกและสะพานเกลือ ( salt bridge) อิเล็กตรอนก็จะถูกถ่ายโอนผ่านตัวกลางภายนอกจากขั้วไฟฟ้าที่เกิดปฏิกิริยาออกซิเดชันไปยังขั้วไฟฟ้าที่เกิดปฏิกิริยารีดักชัน จึงทำให้เกิดกระแสไฟฟ้าได้ เซลล์ไฟฟ้าที่เกิดจากปฏิกิริยาเคมีนี้เรียกว่า เซลล์กัลวานิก หรือเซลล์โวลตาอิก (galvanic cell or voltaic cell) ดังภาพ
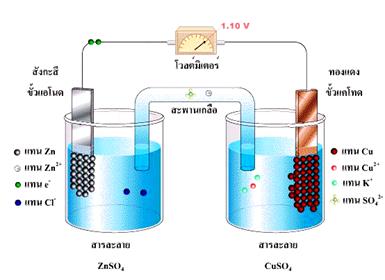
จากรูปเซลล์กัลวานิกประกอบด้วยสองครึ่งเซลล์ โดยแต่ละครึ่งเซลล์จะประกอบด้วยขั้วไฟฟ้าที่จุ่มลงไปในสารละลาย แท่งสังกะสีและแท่งทองแดงในเซลล์เป็นขั้วไฟฟ้าซึ่งเรียกว่า อิเล็กโทรด ( electrode ) ขั้วที่เกิดปฏิกิริยาออกซิเดชัน เรียกว่า ขั้วแอโนด ( anode ) และขั้วที่เกิดปฏิกิริยารีดักชัน เรียกว่า ขั้วแคโทด (cathode)
ปฏิกิริยาออกซิเดชันที่แอโนด ( Zn ) Zn (s )  Zn 2+(aq) + 2e -
Zn 2+(aq) + 2e -
ปฏิกิริยารีดักชันที่แคโทด (Cu ) Cu 2+(aq) + 2e - Cu(s)
Cu(s)
หมายเหตุ : ประจุที่สะสมจะทำให้ออกซิเดชันที่แคโทดและรีดักชันที่แอโนดเกิดยากขึ้น
ระหว่างที่เกิดปฏิกิริยาออกซิเดชันขึ้นที่ขั้วแอโนด Zn จะค่อย ๆ กร่อนแล้วเกิดเป็น Zn 2+ ละลายลงมาในสารละลายที่มี Zn 2+ และ SO 4 2- ส่วนที่ขั้วแคโทด Cu 2+ จากสารละลายเกิดปฏิกิริยารีดักชันกลายเป็นอะตอมของทองแดงเกาะอยู่ที่ผิวของขั้วไฟฟ้า เมื่อปฏิกิริยาดำเนินไปจะพบว่าในครึ่งเซลล์ออกซิเดชันสารละลายจะมีประจุบวก (Zn 2+) มากกว่าประจุลบ (SO 4 2-) และในครึ่งเซลล์รีดักชันสารละลายจะมีประจุลบ (SO 4 2-) มากกว่าประจุบวก (Cu 2+) จึงเกิดความไม่สมดุลทางไฟฟ้าขึ้น ปัญหานี้สามารถที่จะแก้ไขได้โดยการใช้ สะพานเกลือ (salt bridge) เชื่อมต่อระหว่างสองครึ่งเซลล์ ซึ่งสะพานเกลือทำจากหลอดแก้วรูปตัวยู ภายในบรรจุอิเล็กโตรไลต์ที่ไม่ทำปฏิกิริยากับสารในเซลล์และมีไอออนบวก ไอออนลบเคลื่อนที่ด้วยความเร็วใกล้เคียงกัน หรือทำจากกระดาษกรองชุบอิเล็กโตรไลต์ โดยสะพานเกลือทำหน้าที่เป็นตัวกลางที่เชื่อมต่อระหว่างครึ่งเซลล์ทั้งสอง และเป็นสิ่งที่ป้องกันการเกิดการสะสมของประจุโดยไอออนบวกจากสะพานเกลือจะเคลื่อนที่ไปยังครึ่งเซลล์ที่มีประจุลบมาก ในทางตรงกันข้ามไอออนลบก็จะเคลื่อนที่ไปยังครึ่งเซลล์ที่มีประจุมาก จึงทำให้ปฏิกิริยาดำเนินต่อไปได้ในเวลาที่มากขึ้น
และเนื่องจากครึ่งเซลล์ทั้งสองเชื่อมต่อกับวงจรภายนอก ครึ่งเซลล์ที่มีศักย์รีดักชันสูงกว่าจะเกิดรีดักชัน และครึ่งเซลล์ที่มีศักย์รีดักชันต่ำกว่าจะ(ถูกบังคับให้)เกิดออกซิเดชัน ความต่างศักย์ระหว่างอิเล็กโทรดนี้ เรียกว่า แรงเคลื่อนไฟฟ้า (electromotive force: emf) และมีหน่วยเป็น โวลต์ (volt)
เซลล์กัลวานิกแบ่งออกได้เป็น 2 ชนิด
1. เซลล์ปฐมภูมิ (Primary cell) เมื่อปฏิกิริยาเคมีภายในเซลล์เกิดขึ้นและดำเนินไปแล้ว ปฏิกิริยาจะเกิดขึ้นอย่างสมบูรณ์และเกิดปฏิกิริยาย้อนกลับไม่ได้หรือนำมาอัดไฟใหม่ไม่ได้
2 เซลล์ทุติยภูมิ (Secondary cell) เกิดปฏิกิริยาย้อนกลับได้หรือนำมาอัดไฟใหม่ได้
ศักย์ไฟฟ้าอิเล็กโทดมาตรฐาน
จากเซลล์ไฟฟ้า Zn -Cu เมื่อใช้ความเข้มข้นของไอออนของสารละลายในแต่ละครึ่งเซลล์เท่ากับ 1.0 M ที่ 25 ๐C เซลล์ไฟฟ้านี้จะมี emf เท่ากับ 1.10 V ถ้าทราบศักย์ไฟฟ้าของอิเล็กโทรดใดอิเล็กโทรดหนึ่งแล้วนำไปลบออกจาก 1.10 V ก็จะทราบค่าของอิเล็กโทรดหนึ่ง แต่ในทางปฏิบัติไม่สามารถวัดศักย์ไฟฟ้าของอิเล็กโทรดเดี่ยว ๆ ได้ จึงได้มีการกำหนดอิเล็กโทรดมาตรฐานขึ้นมา ซึ่งได้แก่ ไฮโดรเจนอิเล็กโทรดมาตรฐาน (Standard Hydrogen Electrode : SHE) ในครึ่งเซลล์ไฮโดรเจนมาตรฐานนี้ประกอบด้วย ขั้วแพลตินัม (อิเล็กโทรดเฉื่อย) สารละลายกรดไฮโดรคลอริก และก๊าซไฮโดรเจนภายใต้ สภาวะมาตรฐาน ( ความดันของก๊าซไฮโดรเจนเท่ากับ 1 atm ความเข้มข้นของสารละลายกรดไฮโดรคลอริกเท่ากับ 1 M และวัดที่อุณหภูมิ 25 ๐C) โดยผ่านก๊าซไฮโดรเจนในสารละลายกรดไฮโดรคลอริกตลอดเวลา จึงมีสมดุลเกิดขึ้นดังสมการ
2H +(aq) + 2e -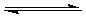 H 2(g)
H 2(g)
ค่าศักย์มาตรฐานของครึ่งเซลล์ไฮโดรเจนมาตรฐานเท่ากับ 0.00 V ใช้สัญลักษณ์ E ๐ แทนศักย์ไฟฟ้าที่สภาวะมาตรฐาน
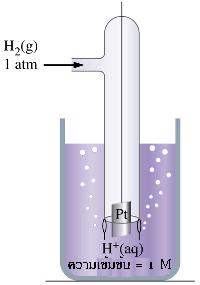
หมายเหตุ : ครึ่งเซลล์เป็นเหมือนอิเล็กโทรดหรือขั้ว
สามารถใช้ครึ่งเซลล์ไฮโดรเจนมาตรฐานนี้ในการหาศักย์ไฟฟ้าของอิเล็กโทรดอื่น เช่น เมื่อต่อเซลล์กัลวานิก ระหว่างครึ่งเซลล์ SHE และครึ่งเซลล์ Cu ดังรูป
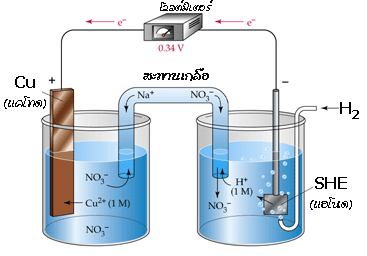
จากโวลต์มิเตอร์ได้ค่าศักย์ไฟฟ้ามาตรฐานของเซลล์เท่ากับ 0.34 V โดยมีปฏิกิริยาเกิดขึ้นดังนี้
ปฏิกิริยาออกซิเดชันที่แอโนด (SHE ) H 2(g) -----------> 2H +(aq) + 2e -
ปฏิกิริยารีดักชันที่แคโทด (Cu ) Cu 2+(aq) + 2e - -----------> Cu(s)
จาก E ๐ cell = E ๐ cathode - E ๐ anode
ดังนั้น E ๐ cell = E ๐ Cu - E ๐ SHE
0.34 V = E ๐ Cu - 0.00 V
E ๐ Cu = 0.34 V - 0.00 V = 0.34 V
เมื่อต่อเซลล์กัลวานิกระหว่างครึ่งเซลล์ SHE และครึ่งเซลล์ Zn จะได้เป็น
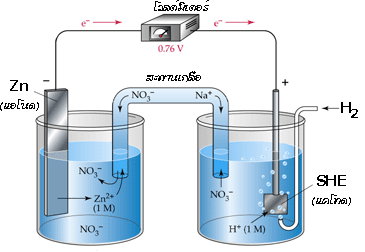
อ่านค่าศักย์ไฟฟ้ามาตรฐานของเซลล์ได้เท่ากับ 0.76 V โดยมีปฏิกิริยาเกิดขึ้น ดังสมการ
ปฏิกิริยาออกซิเดชันที่แอโนด (Zn ) Zn (s )  Zn 2+(aq) + 2e -
Zn 2+(aq) + 2e -
ปฏิกิริยารีดักชันที่แคโทด (SHE ) 2H +(aq) + 2e - H 2(g)
H 2(g)
จาก E ๐ cell = E ๐ cathode - E ๐ anode
ดังนั้น E ๐ cell = E ๐ SHE - E ๐ Zn
0.76 V = 0.00 V - E ๐ Zn
E ๐ Zn = 0.00 V – 0.76 V = -0.76 V
ค่า E ๐ ที่ได้เป็นค่าศักย์รีดักชันของแต่ละครึ่งเซลล์ นั่นคือ
Cu 2+(aq) + 2e - Cu(s) E ๐ = +0.34 V
Cu(s) E ๐ = +0.34 V
Zn 2+(aq) + 2e - Zn(s) E ๐ = -0.76 V
Zn(s) E ๐ = -0.76 V
ศักย์ไฟฟ้ารีดักชันมาตรฐานที่ 25 ๐C (298 K)
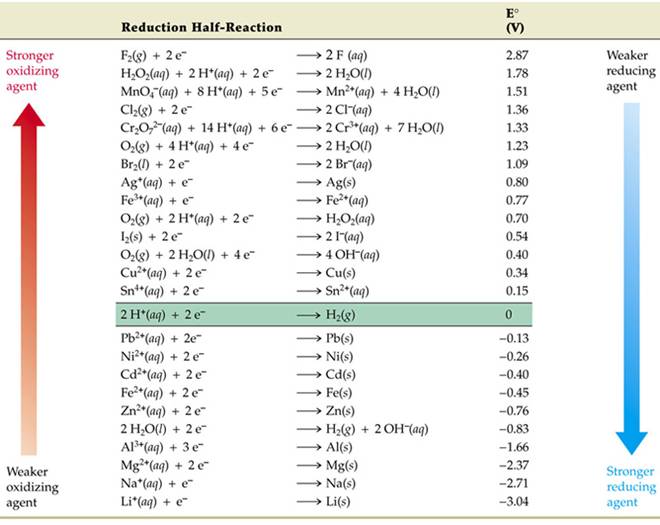
*** ค่า E ๐ เป็นค่าศักย์ไฟฟ้ามาตรฐานของปฏิกิริยารีดักชัน
*** ค่า E ๐ เป็นบวกมาก แสดงว่าตัวออกซิไดซ์ (ด้านซ้ายของสมการ) จะเป็นตัวออกซิไดซ์ที่แรง ส่วนตัวรีดิวซ์ (ด้านขวาของสมการ) จะเป็นตัวรีดิวซ์ที่อ่อน ดังนั้นสารที่อยู่ทางซ้ายของครึ่งปฏิกิริยาใด ๆ จะทำปฏิกิริยาได้เองกับสารที่อยู่ทางขวาของครึ่งปฏิกิริยาที่อยู่ถัดลงมา เช่น
Br 2(l) + 2Ag(s)  2Br -(aq) + 2Ag +aq)
2Br -(aq) + 2Ag +aq)
*** การเปลี่ยนสัมประสิทธิ์ของปฏิกิริยาครึ่งเซลล์ไม่มีผลต่อค่า E ๐
*** เมื่อกลับทิศทางของปฏิกิริยาเป็นปฏิกิริยาออกซิเดชัน ค่า E ๐ จะมีเครื่องหมายตรงข้าม
*** ปฏิกิริยารีดอกซ์ที่เกิดขึ้นได้เอง จะต้องมีค่า E ๐ ของเซลล์เป็นบวกเสมอ
ตัวอย่าง 1 2Ag +(aq) + Mg(s)  2Ag(s) + Mg 2+(aq)
2Ag(s) + Mg 2+(aq)
จาก E ๐ cell = E ๐ cathode - E ๐ anode
= +0.80 V - (-2.37 V) = +3.17 V
ดังนั้น ปฏิกิริยานี้เกิดขึ้นได้เอง
ตัวอย่าง 2 Fe 2+(aq) + Ni(s)  Fe(s) + Ni 2+(aq)
Fe(s) + Ni 2+(aq)
จาก E ๐ cell = E ๐ cathode - E ๐ anode
= -0.44 V - (-0.25 V) = -0.19 V
ดังนั้น ปฏิกิริยานี้เกิดขึ้นเองไม่ได้ ปฏิกิริยาที่เกิดขึ้นได้เองคือ
Fe(s) + Ni 2+(aq)  Fe 2+(aq) + Ni(s)
Fe 2+(aq) + Ni(s)
จากตารางค่าศักย์ไฟฟ้ารีดักชันมาตรฐานและตารางธาตุให้ความสอดคล้องที่สำคัญคือ ธาตุที่เป็นโลหะมีความสามารถในการให้อิเล็กตรอนที่ดี สังเกตได้จากการที่โลหะมีค่า E ๐ ต่ำ มีข้อยกเว้นเพียงโลหะ 4 ชนิด ซึ่งได้แก่ ทองคำ แพลตินัม ทองแดง และเงินเท่านั้น ที่มีความสามารถในการให้อิเล็กตรอนไม่ดี
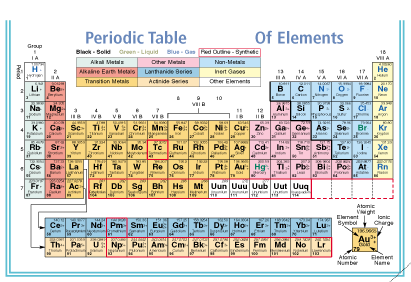
ตารางค่าศักย์ไฟฟ้ารีดักชันมาตรฐานและตารางธาตุไม่ได้ให้ความสอดคล้องของความเป็นโลหะกับค่า E ๐ ทั้งหมด ถ้าพิจารณาให้ดี ธาตุที่มีความเป็นโลหะมากที่สุดควรจะอยู่มุมล่างซ้ายสุดของตารางธาตุ และควรเป็นธาตุที่มีความสามารถให้อิเล็กตรอนได้ดีที่สุด ( พิจารณาจากแนวโน้มของค่าพลังงานไอออไนเซชัน ซึ่งมีแนวโน้มลดลงจากบนลงล่าง) แต่จากค่าตารางค่าศักย์ไฟฟ้ารีดักชันมาตรฐาน Li มี E ๐ ต่ำที่สุด นั่นแสดงว่า Li มีความสามารถให้อิเล็กตรอนได้ดีที่สุด สาเหตุของความไม่สอดคล้องกันนี้ก็คือ พลังงานไอออไนเซชันเป็นค่าที่วัดจากการที่อะตอมให้อิเล็กตรอนเมื่ออยู่ในสภาวะก๊าซ (M(g)  M +(g) + e -) แต่ศักย์ไฟฟ้ามาตรฐานเป็นค่าที่วัดจากการที่อะตอมในสภาวะของแข็งเสียอิเล็กตรอนเกิดเป็นไอออนบวกในน้ำ (M(s)
M +(g) + e -) แต่ศักย์ไฟฟ้ามาตรฐานเป็นค่าที่วัดจากการที่อะตอมในสภาวะของแข็งเสียอิเล็กตรอนเกิดเป็นไอออนบวกในน้ำ (M(s)  M +(aq) + e -) เนื่องจาก Li + มีขนาดเล็ก อัตราส่วนของประจุต่อรัศมีไอออนมีค่าสูง เมื่อ Li + อยู่ในน้ำจะเกิดแรงดึงดูดอย่างแรงกับน้ำ จึงมีความสามารถให้อิเล็กตรอนแล้วเกิดเป็นไอออนได้ดีกว่าโลหะตัวอื่น
M +(aq) + e -) เนื่องจาก Li + มีขนาดเล็ก อัตราส่วนของประจุต่อรัศมีไอออนมีค่าสูง เมื่อ Li + อยู่ในน้ำจะเกิดแรงดึงดูดอย่างแรงกับน้ำ จึงมีความสามารถให้อิเล็กตรอนแล้วเกิดเป็นไอออนได้ดีกว่าโลหะตัวอื่น
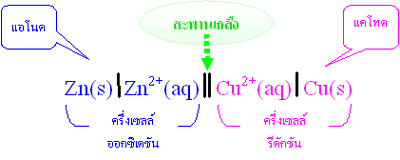
การเขียนแผนภาพของเซลล์กัลวานิกมีหลักดังนี้
1. เขียนครึ่งเซลล์ที่เกิดปฏิกิริยาออกซิเดชันไว้ทางซ้ายมือ โดยเขียนขั้วไฟฟ้าไว้ทางซ้ายสุด ตามด้วยไอออนในสารละลาย และใช้เส้นเดี่ยว / ขีดคั่นระหว่างขั้วไฟฟ้ากับไอออนในสารละลาย เช่น Zn(s)/Zn 2+(aq)
2. เขียนครึ่งเซลล์เซลล์ที่เกิดปฏิกิริยารีดักชันไว้ทางขวามือ โดยเขียนไอออนในสารละลายก่อน ตามด้วยขั้วไฟฟ้าไว้ทางขวาสุด และใช้เส้นเดี่ยว / ขีดคั่นระหว่างขั้วไฟฟ้ากับไอออนในสารละลาย เช่น Cu 2+(aq)/Cu(s)
3. สำหรับครึ่งเซลล์ที่ประกอบด้วยโลหะกับก๊าซ ใช้เส้นเดี่ยว / ขีดคั่นระหว่างขั้วไฟฟ้ากับก๊าซและระหว่างไอออนในสารละลาย เช่น Pt(s)/H 2(g,1 atm)/H +(aq)
4. เขียนเส้นคู่ขนาน // แทนสะพานไอออนกั้นระหว่างครึ่งเซลล์ทั้งสอง เช่น
Zn(s)/Zn 2+(aq)// Cu 2+(aq)/Cu(s)
Pt(s)/H 2(g,1 atm)/H +(1 mol/dm 3)// Cu 2+(1 mol/dm 3)/Cu(s)
5. สำหรับครึ่งเซลล์ที่มีสารสถานะเดียวกันมากกว่าหนึ่งชนิด ให้ใช้เครื่องหมายจุลภาคคั่นระหว่างไอออนทั้งสอง เช่น
Fe(s)/Fe 2+(aq),Fe 3+(aq)// Cu 2+(aq)/Cu(s)
เซลล์ปฐมภูมิมีหลายชนิด เช่น
1. เซลล์แห้ง (Dry Cell ) หรือเซลล์เลอคลังเช (LeClanche Cell)
เซลล์ไฟฟ้าชนิดนี้ถูกเรียกว่า เซลล์แห้ง เพราะไม่ได้ใช้ของเหลวเป็นอิเล็กโทรไลต์ เป็นเซลล์ที่ใช้ในไฟฉาย หรือใช้ในประโยชน์อื่น ๆ เช่น ในวิทยุ เครื่องคิดเลข ฯลฯ ซึ่งมีลักษณะตามรูป
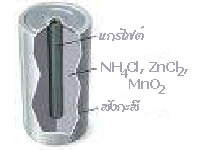
ส่วนประกอบของเซลล์แห้ง
กล่องของเซลล์ทำด้วยโลหะสังกะสีซึ่งทำหน้าที่เป็นขั้วแอโนด (ขั้วลบ) ส่วนแท่งคาร์บอนหรือแกรไฟต์อยู่ตรงกลางทำหน้าที่เป็นขั้วแคโทด (ขั้วบวก) ระหว่างอิเล็กโตรดทั้งสองบรรจุด้วยของผสมชื้นของแอมโมเนียมคลอไรด์ (NH 4Cl) แมงกานีส (IV ) ออกไซด์ (MnO 2) ซิงค์คลอไรด์ (ZnCl 2) ผงคาร์บอน ตอนบนของเซลล์ผนึกด้วยวัสดุที่สามารถรักษาความชื้นภายในเซลล์ให้คงที่ มีปฏิกิริยาเกิดขึ้นดังนี้
ที่ขั้วแอโนด (Zn -ขั้วลบ) Zn ถูกออกซิไดซ์กลายเป็น Zn 2+
ที่ขั้วแอโนด (Zn -ขั้วลบ) Zn ถูกออกซิไดซ์กลายเป็น Zn 2+
Zn(s)  Zn 2+(aq) + 2e -
Zn 2+(aq) + 2e -
ที่ขั้วแคโทด (C -ขั้วบวก) MnO 2 จะถูกรีดิวซ์ ไปเป็น Mn 2O 3
2MnO 2(s) + 2NH 4 ++(aq) + 2e - Mn 2O 3(s) + H 4O(l)
Mn 2O 3(s) + H 4O(l)
ดังนั้นปฏิกิริยารวมจึงเป็น
Zn(s) + 2MnO 2(s) + 2NH 4 +(aq)  Zn 2+(aq) + Mn 2O 3(s) + 2NH 3(g) + H 2O(l)
Zn 2+(aq) + Mn 2O 3(s) + 2NH 3(g) + H 2O(l)
แก๊ส NH 3 ที่เกิดขึ้นจะเข้าทำปฏิกิริยากับ Zn 2+ เกิดเป็นไอออนเชิงซ้อนของ [Zn (NH 3) 4] 2+ และ [Zn(NH 3) 2(H 2O) 2] 2+ การเกิดไอออนเชิงซ้อนนี้จะช่วยรักษาความเข้มข้นของ Zn 2+ ไม่ให้สูงขึ้น จึงทำให้ศักย์ไฟฟ้าของเซลล์เกือบคงที่เป็นเวลานานพอสมควร จากปฏิกิริยารวมจะสังเกตว่ามีน้ำเป็นผลิตภัณฑ์ด้วย ดังนั้นเซลล์ที่เสื่อมสภาพจึงบวมและมีน้ำไหลออกมา และเซลล์แห้งนี้จะให้ศักย์ไฟฟ้าประมาณ 1.5 โวลต์
2. เซลล์แอลคาไลน์ (Alkaline Cell )
เซลล์แอลคาไลน์มีส่วนประกอบของเซลล์เหมือนกับเซลล์เลอคลังเช แต่มีสิ่งที่แตกต่างกันคือเซลล์แอลคาไลน์ใช้ เบสซึ่งได้แก่โพแตสเซียมไฮดรอกไซด์ (KOH ) เป็นอิเล็กโทรไลต์แทนแอมโมเนียมคลอไรด์ (NH 4Cl) และเนื่องจากใช้สารละลายเบสนี่เองเซลล์ชนิดนี้จึงถูกเรียกว่า เซลล์แอลคาไลน์
ที่ขั้วแอโนด (Zn -ขั้วลบ) Zn ถูกออกซิไดซ์
Zn(s) + 2OH -(aq)  ZnO(s) + H 2O(l) + 2e -
ZnO(s) + H 2O(l) + 2e -
ที่ขั้วแคโทด (C -ขั้วบวก) MnO 2 จะถูกรีดิวซ์ ไปเป็น Mn 2O 3
2MnO 2(s) + H 2O(l) + 2e - Mn 2O 3(s) + 2OH -(aq)
Mn 2O 3(s) + 2OH -(aq)
สมการรวม Zn (s ) + 2MnO 2(s)  ZnO(s) + Mn 2O 3(s)
ZnO(s) + Mn 2O 3(s)
เซลล์นี้จะให้ศักย์ไฟฟ้าประมาณ 1.5 โวลต์ แต่ให้กระแสไฟฟ้าได้มากกว่าและนานกว่าเซลล์แห้ง เพราะ OH - ที่เกิดขึ้นที่ขั้วคาร์บอนสามารถนำกลับไปใช้ที่ขั้วสังกะสีได้
3. เซลล์ปรอท (Mercury Cell )
มีหลักการเช่นเดียวกับเซลล์แอลคาไลน์ แต่ใช้เมอร์คิวรี (II ) ออกไซด์ (HgO ) แทนแมงกานีส (IV ) ออกไซด์ (MnO 2) เป็นเซลล์ที่มีขนาดเล็กใช้กันมากในเครื่องฟังเสียงสำหรับคนหูพิการ หรือใช้ในอุปกรณ์อื่น เช่น นาฬิกาข้อมือ เครื่องคิดเลข เซลล์นี้จะให้ศักย์ไฟฟ้าประมาณ 1.3 โวลต์ ให้กระแสไฟฟ้าต่ำ แต่สามารถให้ค่าศักย์ไฟฟ้าคงที่ตลอดอายุการใช้งาน มีปฏิกิริยาเคมีดังนี้
ที่ขั้วแอโนด Zn (s ) + 2OH -(aq)  ZnO(s) + H 2O(l) + 2e -
ZnO(s) + H 2O(l) + 2e -
ที่ขั้วแคโทด HgO (s ) + H 2O(l) + 2e - Hg(l) + 2OH -(aq)
Hg(l) + 2OH -(aq)
ปฏิกิริยารวม Zn (s ) + HgO (s )  ZnO(s) + Hg(l)
ZnO(s) + Hg(l)
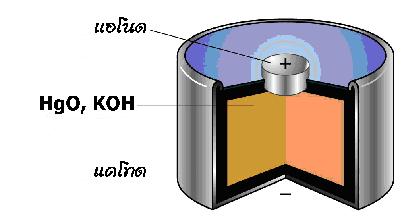
ส่วนประกอบของเซลล์ปรอท
เซลล์ทุติยภูมิมีหลายชนิด เช่น
1. แบตเตอรี่สะสมไฟฟ้าแบบตะกั่ว ( Lead Storage Battery)
แบตเตอรี่คือเซลล์ไฟฟ้าหลาย ๆ เซลล์ต่อกันเป็นอนุกรม แบตเตอรี่สะสมไฟฟ้าแบบตะกั่วนี้เป็นแบตเตอรีที่ใช้ในรถยนต์ โดยประกอบด้วยเซลล์ไฟฟ้า 6 เซลล์ แต่ละเซลล์จะมีศักย์ไฟฟ้า 2 โวลต์ ดังนั้นแบตเตอรี่ในรถยนต์มีศักย์ไฟฟ้า 12 โวลต์
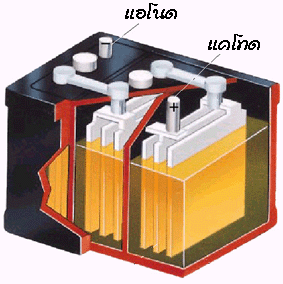
ส่วนประกอบของแบตเตอรี่สะสมไฟฟ้าแบบตะกั่ว
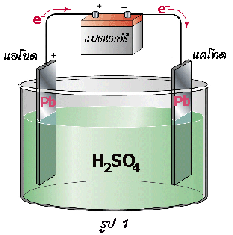
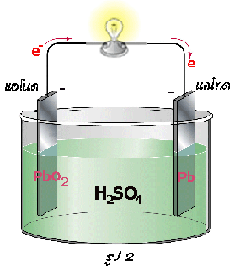
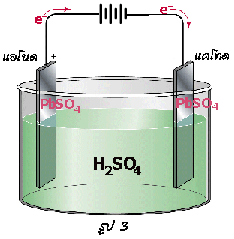
เซลล์สะสมไฟฟ้าแบบตะกั่ว
1) เมื่ออัดไฟครั้งแรก 2) เมื่อจ่ายไฟ 3) เมื่ออัดไฟครั้งต่อไป
1) เมื่ออัดไฟครั้งแรก 2) เมื่อจ่ายไฟ 3) เมื่ออัดไฟครั้งต่อไป
แบตเตอรี่สะสมไฟฟ้าแบบตะกั่วจะประกอบด้วยอิเล็กโทรดคือแผ่นตะกั่ว มีกรดซัลฟิวริกเจือจางเป็นอิเล็กโทรไลต์ เมื่อมีการอัดไฟครั้งแรกแผ่นตะกั่วที่ต่อกับขั้วบวกของแบตเตอรี (ขั้วแอโนด) จะถูกออกซิไดซ์เป็นเลด (II ) ไอออน ดังสมการ
Pb(s)  Pb 2+(aq) + 2e -
Pb 2+(aq) + 2e -
เมื่อรวมกับออกซิเจนที่เกิดขึ้นจะกลายเป็นเลด (IV ) ออกไซด์
Pb 2+(aq) + O 2(g)  PbO 2(s)
PbO 2(s)
ดังนั้นที่ขั้วแอโนด (ขั้วบวก) แผ่นตะกั่วจะถูกเปลี่ยนเป็นเลด (IV ) ออกไซด์ขั้วไฟฟ้าจึงแตกต่างกัน (ขั้วแอโนด-ขั้วบวก: PbO 2 และขั้วแคโทด-ขั้วลบ: Pb) ทำให้สามารถเกิดกระแสไฟฟ้าได้หรือจ่ายไฟได้นั่นเอง
การจ่ายไฟเกิดขึ้น ดังสมการ
การจ่ายไฟเกิดขึ้น ดังสมการ
ขั้วแอโนด-ขั้วลบ: Pb (s ) + SO 4 2-(aq)  PbSO 4(s) + 2e -
PbSO 4(s) + 2e -
ขั้วแคโทด-ขั้วบวก: PbO 2(s) + SO 4 2-(aq) + 4H +(aq) + 2e - PbSO 4(s) + 2H 2O(l)
PbSO 4(s) + 2H 2O(l)
อิเล็กตรอนจะเคลื่อนที่จากขั้วแอโนดหรือขั้วลบผ่านวงจรภายนอกไปยังขั้วแคโทดหรือขั้วบวก จากสมการจะสังเกตได้ว่ามีผลิตภัณฑ์คือ PbSO 4(s) เกิดขึ้นเหมือนกัน ดังนั้นเมื่อใช้แบตเตอรี่ไประยะหนึ่งความต่างศักย์จะลดลง และจะลดลงไปเรื่อย ๆ จนกระทั่งเป็นศูนย์ ทั้งนี้เนื่องจากขั้วไฟฟ้าทั้งคู่เหมือนกัน จึงไม่มีความแตกต่างของศักย์ไฟฟ้าระหว่างขั้วทั้งสอง
ปฏิกิริยาของเชลล์ข้างบนเป็นผันกลับได้ ดังนั้นถ้าต้องการให้เกิดการผันกลับจึงจำเป็นต้องมีการอัดไฟฟ้าใหม่ โดยการต่อขั้วบวกของเซลล์กับขั้วบวกของแบตเตอรี่และขั้วลบกับขั้วลบของแบตเตอรี่ ปฏิกิริยาข้างบนก็จะเปลี่ยนทิศทางเป็นจากขวาไปซ้าย ในลักษณะนี้เลด(II ) ซัลเฟตที่ขั้วลบก็จะเปลี่ยนเป็นตะกั่ว ส่วนอีกขั้วหนึ่ง เลด (II ) ซัลเฟตจะเปลี่ยนเป็นเลด (IV ) ออกไซด์ ดังสมการ
ขั้วแอโนด-ขั้วบวก: PbSO 4(s) + 2H 2O(l) PbO 2(s) + SO 4 2-(aq) + 4H +(aq) + 2e -
PbO 2(s) + SO 4 2-(aq) + 4H +(aq) + 2e -
ขั้วแคโทด-ขั้วลบ: PbSO 4(s) + 2e - Pb(s) + SO 4 2-(aq)
Pb(s) + SO 4 2-(aq)
จากปฏิกิริยาในขณะที่มีการจ่ายไฟฟ้า ความเข้มข้นของกรดจะลดลงเรื่อย ๆ จากปกติที่มีความถ่วงจำเพาะ ประมาณ 1.25 ถึง 1.30 แล้วแต่อุณหภูมิในขณะนั้น ๆ ถ้าหากเมื่อใดมีความถ่วงจำเพาะต่ำกว่า 1.20 ที่อุณหภูมิของห้องก็ควรจะมีการอัดไฟฟ้าใหม่ได้
2. ซลล์นิกเกิล-แคดเมียม หรือเซลล์นิแคด (Nickel-Cadmium Cell)

ที่ขั้วแอโนด: Cd(s) + 2OH -(aq)  Cd(OH) 2(s) + 2e -
Cd(OH) 2(s) + 2e -
ที่ขั้วแคโทด: NiO 2(s) + 2H 2O(l) + 2e - Ni(OH) 2(s) + 2OH -(aq)
Ni(OH) 2(s) + 2OH -(aq)
ปฏิกิริยารวม: Cd(s) + NiO 2(s) + 2H 2O(l)  Cd(OH) 2(s) + Ni(OH) 2(s)
Cd(OH) 2(s) + Ni(OH) 2(s)
3. เซลล์ลิเทียมไอออน ( Lithium Ion Cell)
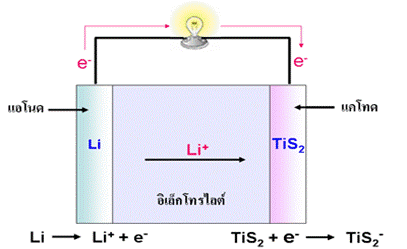

เซลล์ลิเทียมอาจให้ศักย์ไฟฟ้าสูงถึง 3 โวลต์ เป็นเซลล์ที่ใช้อิเล็กโทรไลต์เป็นของแข็งได้แก่สารพอลิเมอร์ที่ยอมให้ไอออนผ่านแต่ไม่ยอมให้อิเล็กตรอนผ่าน ขั้วแอโนดคือลิเทียมซึ่งเป็นธาตุที่มีค่าศักย์ไฟฟ้ารีดักชันมาตรฐานต่ำที่สุด มีความสามารถในการให้อิเล็กตรอนได้ดีที่สุด ส่วนแคโทดใช้สารที่เรียกว่าสารประกอบแทรกชั้น (Insertion Compound ) ได้แก่ TiS 2 หรือ V 6O 13
เซลล์อิเล็กโทรไลต์
เมื่อผ่านไฟฟ้าเข้าไปในเซลล์ที่ประกอบด้วยขั้วไฟฟ้าสองขั้วจุ่มอยู่ในสารละลายอิเล็กโทรไลต์ จะเกิดปฏิกิริยาเกิดขึ้นภายในเซลล์ เรียกกระบวนการนี้ว่า อิเล็กโทรลิซิส ( electrolysis ) และเรียกเซลล์ไฟฟ้าเคมีนี้ว่า เซลล์อิเล็กโทรไลต ์ ดังรูป
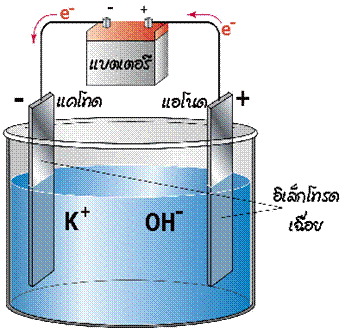
ในการพิจารณาขั้วบวก/ขั้วลบจะพิจารณาจากปริมาณอิเล็กตรอนว่ามีมากหรือน้อย
- เซลล์แกลแวนิก ขั้วที่เกิดออกซิเดชันมีอิเล็กตรอนสะสม(จากภายใน) จึงเป็นขั้วลบ
- เซลล์แกลแวนิก ขั้วที่เกิดรีดักชันมีอิเล็กตรอนสะสม(จากภายนอก) จึงเป็นขั้วลบ
ในเมื่อแบตเตอรี่เป็นตัวจ่ายกระแสไฟฟ้า อิเล็กตรอนจะเคลื่อนที่ออกจากขั้วแอโนด (ขั้วลบ) ของแบตเตอรี่ผ่านลวดตัวนำไปยังขั้วไฟฟ้าของเซลล์อิเล็กโทรไลต์ ดังนั้นขั้วไฟฟ้าที่ต่อกับขั้วลบของแบตเตอรี่จะเป็นขั้วแคโทด เพราะเป็นขั้วที่เกิดปฏิกิริยารีดักชัน และเนื่องจากต่อกับขั้วลบ ขั้วไฟฟ้านี้จึงเป็นขั้วลบ ส่วนขั้วไฟฟ้าอีกขั้วหนึ่งเกิดปฏิกิริยาออกซิเดชันจึงเป็นขั้วแอโนด และต่อกับขั้วบวกของแบตเตอรี่จึงเป็นขั้วบวก อิเล็กตรอนเคลื่อนที่ออกจากขั้วแอโนดของเซลล์เข้าสู่แบตเตอรี่
ประโยชน์ของเซลล์อิเล็กโทรไลต์
การชุบโลหะ
การชุบช้อนโลหะด้วยเงิน
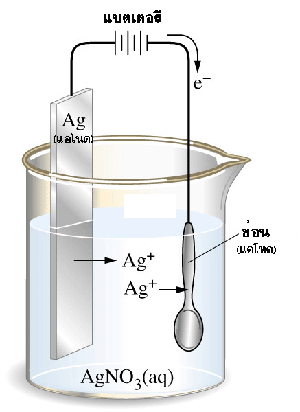
จากรูป การชุบช้อนโลหะด้วยเงิน ต้องใช้เงินเป็นแอโนด ช้อนโลหะเป็นแคโทด และใช้สารละลายซิลเวอร์ไนเตรตเป็นสารละลายอิเล็กโทรไลต์
ขั้วแอโนด: Ag: Ag(s)
ขั้วแคโทด: ช้อน: Ag +(aq) + e -
|
เซลล์แกลแวนิกและเซลล์อิเล็กโทรไลต์
เซลล์แกลแวนิก
|
เซลล์อิเล็กโทรไลต ์
|
| 1. จากปฏิกิริยาเคมีเป็นพลังงานไฟฟ้า | 1. จากพลังงานไฟฟ้าเป็นปฏิกิริยาเคมี |
| 2. เป็นปฏิกิริยาที่สามารถเกิดขึ้นได้เอง | 2. เป็นปฏิกิริยาที่ไม่สามารถเกิดขึ้นได้เอง ต้องใช้พลังงานไฟฟ้าทำให้เกิดปฏิกิริยา |
| 3. ค่าศักย์ไฟฟ้าของเซลล์เป็นบวกเสมอ | 3. ค่าศักย์ไฟฟ้าของเซลล์เป็นลบ |
| 4. ขั้วแอโนดเกิดปฏิกิริยาออกซิเดชันเป็นขั้วลบ ขั้วแคโทดเกิดปฏิกิริยารีดักชันเป็นขั้วบวก | 4. ขั้วแอโนดเกิดปฏิกิริยาออกซิเดชันเป็นขั้วบวก ขั้วแคโทดเกิดปฏิกิริยารีดักชันเป็นขั้วลบ |
สมัครสมาชิก:
ความคิดเห็น (Atom)















